Eine Kristallspur verrät den Weg von Motorproteinen
Genfer Forschenden ist es gelungen, erstmals direkt den Weg eines sogenannten Motorproteins in Zellen zu verfolgen. Dafür entwickelten sie einen fluoreszierenden Farbstoff, der eine kristalline Spur hinterlässt, wenn sich das Kinesin-1-Protein bewegt.
Das Wichtigste in Kürze
- Motorproteine sind die Arbeitstiere in den Zellen und treiben als molekulare Maschinen viele lebenswichtige Prozesse an: Sie bewegen sich - beladen etwa mit Molekülen - von A nach B entlang von winzigen Autobahnen, sogenannten Mikrotubuli.
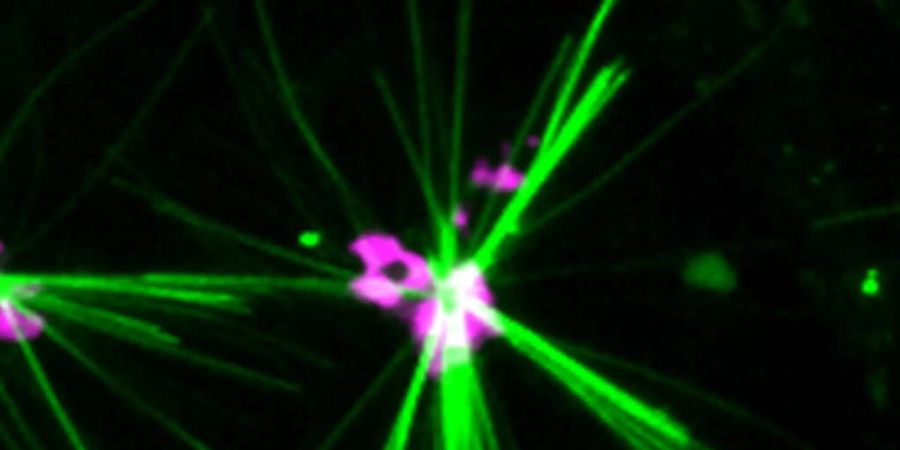
Um die Frachtproteine zu verfolgen, nutzten Forschende der Universität Genf einen neu entwickelten fluoreszierenden Farbstoff. So gelang es ihnen, gezielt ein einziges, bestimmtes aus Bakterien isoliertes Motorprotein - nämlich Kinesin-1 - auf seinem Weg durch das Strassengeflecht in verschiedenen Zelllinien, darunter menschlichen Zellen, zu verfolgen. Darüber berichten die Forschenden im Fachmagazin «Nature Communications».
Bei jedem kleinen Schritt, den dieses Kinesin-Protein macht, verbraucht es Energie, die den Farbstoff kristallisieren lässt. So bildet sich eine fluoreszierende Spur, die sich sichtbar machen lässt. Der Clou: Der Farbstoff beginnt tatsächlich erst bei der Interaktion mit dem sich bewegenden Motorprotein zu fluoreszieren. Bislang war das Problem mit dauerhaft fluoreszierenden Farbstoffen nämlich, dass sie die Bewegung der Proteine überschatteten.
Insgesamt gibt es 45 unterschiedliche Kinesin-Typen, die zu einer bestimmten Gruppe von Motorproteinen gehören. Um die Wege aller Typen sichtbar zu machen, müsste die Struktur des fluoreszierenden Moleküls spezifisch angepasst werden, schrieb die Genfer Biochemikerin Charlotte Aumeier auf Anfrage von Keystone-SDA. «Aber wir gehen davon aus, dass dies machbar ist.»
Die Entdeckung resultierte übrigens aus einem erst fehlgeschlagenen Experiment, wie Nicolas Winssinger von der Uni Genf in einer Mitteilung der Hochschule erzählte. Ursprünglich war nämlich der Plan, ein Molekül zu entwickeln, das den Stresslevel einer Zelle sichtbar macht. Doch weil dieses kristallisierte, wurde der Plan zunichtegemacht.










