Mögliches Corona-Mittel Remdesivir vorläufig in EU zugelassen
Das Medikament Remdesivir des US-Herstellers Gilead wird in Europa vorläufig zur Behandlung von Corona-Patienten zugelassen.
Das Wichtigste in Kürze
- Wirksamkeit und Nebenwirkungen sollen weiter getestet werden.
Die EU-Kommission erteilte am Freitag entsprechend einer Empfehlung der Europäischen Arzneimittelagentur (EMA) und nach Zustimmung der Mitliedstaaten eine bedingte Marktzulassung. «Wir erteilen diese Genehmigung weniger als einen Monat nach Einreichung des Antrags», erklärte Gesundheitskommissarin Stella Kyriakides. Das sei ein wichtiger Schritt im Kampf gegen das Virus.
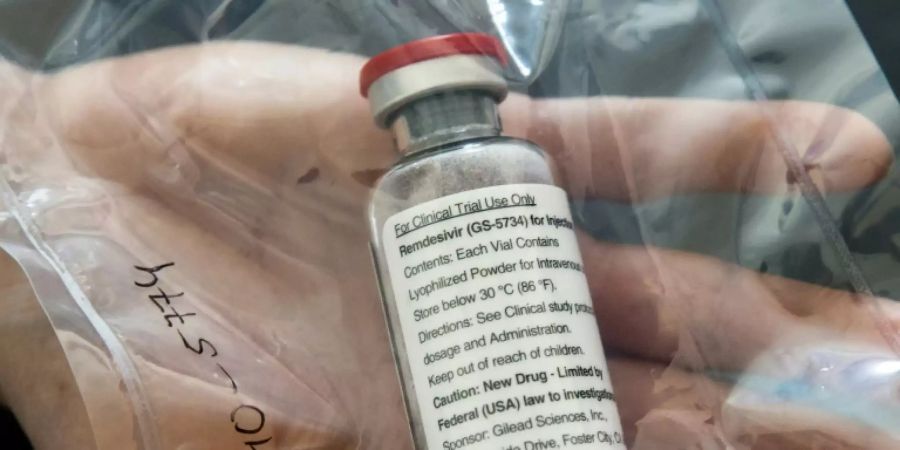
Die EMA empfiehlt die Zulassung von Remdesivir ausschliesslich für die Behandlung von erwachsenen Corona-Patienten sowie von Jugendlichen ab zwölf Jahren, die an einer Lungenentzündung leiden und mit Sauerstoff versorgt werden müssen. Die Bewertung fusst im Wesentlichen auf einer Studie des US-Instituts für Allergien und Infektionskrankheiten (NIAID). Darin heisst es, dass Remdesivir die Behandlung von Corona-Patienten erheblich beschleunigen, jedoch vermutlich nicht die Sterblichkeitsrate senken könne.
Remdesivir wurde von dem US-Konzern Gilead eigentlich zur Behandlung von Ebola entwickelt. In den USA und Japan erhielt das Medikament bereits Ausnahmegenehmigungen für die Behandlung von Infektionen mit dem neuartigen Coronavirus. Die bedingte Marktzulassung in der EU bedeutet nun, dass die Wirkung und mögliche Nebenwirkungen während der Behandlung weiter untersucht werden.
Die EU-weite Versorgung mit dem Mittel ist allerdings fraglich. Die US-Regierung hatte Anfang der Woche mitgeteilt, sich nahezu die gesamte Produktion des Mittels für die nächsten Monate gesichert zu haben. Präsident Donald Trump habe einen «unglaublichen Deal» erzielt, damit jeder US-Patient, der Remdesivir benötige, Zugang zu dem Medikament erhalte, erklärte Gesundheitsminister Alex Azar.
Nach Angaben des Bundesgesundheitsministeriums ist das Mittel in Deutschland dennoch in ausreichendem Masse verfügbar, weil es Reserven gebe. Zudem sei mit der Zulassung auch eine Verpflichtung für Gilead verbunden, «in einem angemessenen Umfang» Remdesivir nach Europa zu liefern. Das Ministerium gehe davon aus, dass der Pharmahersteller dem nachkommen werde, sagte ein Sprecher am Mittwoch.
«Ich halte es für notwendig, dass Gilead sein Wissen mit anderen Unternehmen teilt und diese auch als Wettbewerber in den Markt lässt», forderte der gesundheitspolitische Sprecher der Europa-CDU, Peter Liese. Im Zweifelsfall könnten die EU-Staaten gemeinsam auch «Zwangslizenzen» erteilen.
Liese zufolge hat das Unternehmen auch selbst ein Interesse daran, die Europäer «fair» zu behandeln: «Sie können jetzt möglicherweise mit Remdesivir zwölf Monate lang ein sehr gutes Geschäft machen, aber wenn es dann einen Impfstoff gibt, (...) dann muss die Firma wieder von ihren anderen Produkten leben», erklärte der EU-Abgeordnete.
Der Kölner Infektiologe Gerd Fätkenheuer, der an einer internationalen Studie zur Wirksamkeit von Remdesivir gegen Corona beteiligt war, hatte zuletzt die von der Pharmafirma geforderten Preise als «enorm hoch» kritisiert. «Ich würde schon erwarten, dass gesamtgesellschaftliche und ethische Gesichtspunkte bei einem Medikament wie Remdesivir eine Rolle spielen», sagte er dem «Kölner Stadt-Anzeiger». In den USA soll eine Ampulle demnach 390 Dollar kosten.
Gilead begrüsste die bedingte Zulassung der EU-Kommission als «wichtigen Schritt vorwärts». «Wir arbeiten gemeinsam daran, den Behandlungsbedarf der Patienten in ganz Europa zu decken», erklärte der Chef der Medizinabteilung des Unternehmens, Merdad Parsey.














